2-й семестр
МОЛЕКУЛЯРНА ФІЗИКА Й ТЕРМОДИНАМІКА
1. Властивості газів, рідин, твердих тіл
Урок 7/78
Тема. Основне рівняння МКТ ідеального газу
Мета уроку: з’ясувати механізм тиску ідеального газу і його залежність від мікропараметрів
Тип уроку: вивчення нового матеріалу
План уроку
Контроль знань | 5 хв. | 1. Закон Гей-Люсака. 2. Закон Шарля. 3. Закон Бойля-Маріотта. 4. Графіки ізопроцесів |
Демонстрації | 3 хв. | 1. 2. Фрагмент відеофільму “Молекули й молекулярний рух” |
Вивчення нового матеріалу | 25 хв. | 1. Основне рівняння молекулярно-кінетичної теорії ідеального газу. 2. Зв’язок тиску з середньою кінетичною енергією молекул |
Закріплення вивченого матеріалу | 12 хв. | 1. Тренуємося розв’язувати задачі. 2. Контрольні запитання |
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Основне рівняння молекулярно-кінетичної теорії ідеального газу
Основне завдання молекулярно-кінетичної теорії газу полягає в тому,
Оскільки тиск газу на стінку посудини зумовлений ударами молекул, тиск газу пропорційний концентрації молекул n: чим більше молекул в одиниці об’єму, тим більше ударів молекул об стінку за одиницю часу. Кожна молекула при ударі об стінку передає їй імпульс, пропорційний імпульсу молекули, рівному по модулю m0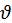 , де
, де 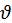 – модуль швидкості молекули. Тому можна було б очікувати, що тиск пропорційний nm0
– модуль швидкості молекули. Тому можна було б очікувати, що тиск пропорційний nm0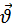 , де
, де 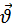 – середнє значення модуля швидкості молекул.
– середнє значення модуля швидкості молекул.
Однак, насправді тиск пропорційний не першому, а другому ступеню швидкості, так як, чим більша швидкість молекули, тим частіше вона б’ється об стінку посудини. І дійсно, розрахунки показують, що основне рівняння молекулярно-кінетичної теорії ідеального газу має вигляд:

Де m0 – маса однієї молекули газу, n – концентрація молекул, 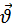 2 – середнє значення квадрата швидкості молекул.
2 – середнє значення квадрата швидкості молекул.
Коефіцієнт 1/3 зумовлений тривимірністю простору – тим, що під час хаотичного руху молекул всі три напрями рівноправні.
Отже, німецький фізик Р. Клаузиус з’ясував, що тиск ідеального газу прямо пропорційний концентрації частинок, маси частки й середнього значення квадрата швидкості частинки.
Отримане рівняння пов’язує макроскопічну величину – тиск,- що може бути виміряна манометром, з мікроскопічними величинами, що характеризують молекули, і є ніби містком між двома світами: макроскопічним і мікроскопічним.
2. Зв’язок тиску з середньою кінетичною енергією молекули
Якщо через  позначити середню кінетичну енергію поступального руху молекули
позначити середню кінетичну енергію поступального руху молекули  то рівняння Клапейрона можна записати у вигляді:
то рівняння Клапейрона можна записати у вигляді:

Тиск ідеального газу пропорційний добутку концентрації молекул на середню кінетичну енергію поступального руху молекули У цій формулі концентрація часток характеризує число ударів молекул об поршень, а середня кінетична енергія молекул визначає інтенсивність одного удару.
Питання до учнів під час викладення нового матеріалу
1. Який механізм виникнення тиску газу, з точки зору молекулярно-кінетичної теорії будови речовини?
2. Чому можна вважати, що молекули в газі рухаються лише вздовж трьох взаємно перпендикулярних напрямів?
3. У яких шарах атмосфери повітря зі своїми властивостями наближається до ідеального газу: біля поверхні Землі чи на далеких висотах?
ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1). Тренуємося розв’язувати задачі
Кисень знаходиться в нормальних умовах. Обчисліть середню квадратичну швидкість молекул газу.
Розв’язок
За нормальних умов тиск кисню дорівнює 1,01-105 Па, а густина – 1,43 кг/м3. Вважаючи, що концентрація газу n = N/V, можна записати:

Звідси отримуємо: 
Перевіривши одиниці величин і виконавши розрахунки, отримуємо  = 460 м/с.
= 460 м/с.
2. Визначте кінетичну енергію хаотичного поступального руху всіх молекул будь-якого газу в балоні об’ємом 5 л з тиском 1 МПа.
3. Чому дорівнює середня кінетична енергія хаотичного руху молекул аргону, якщо 2 кг його, перебуваючи в посудині об’ємом 2 м3, чинять тиск 3-105 Па?
2). Контрольні запитання
1. Яким чином в основному рівнянні молекулярно-кінетичної теорії ми отримали множник 1/3?
2. Чому молекула при зіткненні зі стінкою посудини діє на неї з силою, пропорційною швидкості, а тиск пропорційно квадрату швидкості?
3. Як середня кінетична енергія молекул залежить від концентрації газу та його тиску на стінки посудини?
Що ми дізналися на уроці:
– Тиск ідеального газу прямо пропорційний концентрації часток, масі частки й середньому значенню квадрата швидкості частки.

– Тиск ідеального газу пропорційний добутку концентрації молекул на середню кінетичну енергію поступального руху молекули:

Домашнє завдання
1. Конспект.
2. Розв’яжіть задачі:
Р1): 1. Як зміниться тиск газу, якщо концентрація його молекул збільшиться в 3 рази, а середня квадратична швидкість молекул зменшиться в 3 рази?
2. Під яким тиском знаходиться газ в посудині, якщо середня квадратична швидкість його молекул 103 м/с, концентрація молекул 3-1025 м-3, а маса кожної молекули 5-10-26 кг?
3. Визначте середню кінетичну енергію поступального руху молекул газу з тиском 105 Па. Концентрація молекул газу 2,7-1025 м-3.
Р2): 1. Визначте густину кисню, який знаходиться під тиском 1,3-105 Па. Середня квадратична швидкість молекул 1,4-103 м/с.
2. Який тиск на стінки посудини чинять молекули газу, якщо маса газу 3 г, об’єм 5-10-4 м3, середня квадратична швидкість молекул 500 м/с?
3. Яка середня квадратична швидкість руху молекул газу, який займає об’єм 5 м3 з тиском 2-105 Па і має масу 6 кг?
Р3): 1. Який тиск вуглекислого газу, якщо в балоні об’ємом 40 л міститься 5-1024 молекул, а середня квадратична швидкість молекул 400 м/с?
2. Визначте кінетичну енергію хаотичного поступального руху всіх молекул будь-якого газу в балоні об’ємом 10 л і тиском 4-105 Па.
3. Частина стінки посудини покрили клеєм, що поглинає всі падаючі молекули газу. Чи зміниться тиск газу на цю ділянку стінки? Обгрунтуйте свою відповідь.
