Тема 1 Початкові хімічні поняття
& 12. Відносна молекулярна маса речовини. Масова частка елемента в складній речовині
Опанувавши цю тему, ви зможете:
– розуміти поняття “відносна молекулярна маса”, “масова частка елемента в складній речовині”;
– уміти обмислювати відносну молекулярну масу за формулами речовин, масову частку елемента в складній речовині;
– формувати навички в обчисленнях за хімічними формулами.
– Висловте припущення, чи можна обчислити масу структурних частинок речовин. На чому
Вам уже відомо, що атоми елементів характеризуються певною масою. Тому молекулам теж притаманна певна маса. Проте їхня абсолютна маса, як і атомна, с також дуже малою. Тому, як і для маси атомів, уживають поняття “відносна молекулярна маса”. Позначають її Мr.
Відносна молекулярна маса – це число, яке показує, у скільки разів маса певної молекули більша від 1/12 маси атома Карбону-12.
Зазвичай обчислюють відносну молекулярну масу за сумою відносних атомних мас елементів, з яких складається молекула.
Поняття “відносна молекулярна маса” належить до молекулярних
Розглянемо приклади.
Вправа 1. Обчисліть відносну молекулярну масу карбонy (IV) оксиду, формула якого – СО2.
Мr (СO2) = Ar(С) + 2Аr (О) = 12 + 2 ∙ 16 = 44.
Вправа 2. Обчисліть відносну формульну масу натрій карбонату, формула якого – NaСО3.
Mr (Na2CO3) = 2Ar (Na) + Ar (С) + 3Ar(O) – 2 ∙ 23 + 12 + 3 ∙ 16 = 106.
– Пригадайте, як характеризують речовину за хімічною формулою. Які обчислення здійснюють на основі хімічної формули?
Масова частка елемента в складній речовині. Окрім уже відомих вам обчислень, за хімічною формулою можна знаходити масові частки елементів у сполуці.
Масова частка елемента – це відношення маси елемента до маси сполуки.
Математично це виражається формулою
W (E) =  або w (E)
або w (E)  ∙ 100%.
∙ 100%.
Де w (“дубль-ве”) – масова частка елемента; n – число атомів елемента; Аr- відносна атомна маса елемента; Мr – відносна молекулярна маса.
Масова частка не має розмірності. Її виражають у частках від одиниці або у відсотках. Отже, сума масових часток усіх елементів у сполуці дорівнює 1 або 100 %.
Розглянемо на прикладах, як обчислюють масові частки елементів у сполуках.
Пригадайте з курсу математики, що таке відсоток.
Задача 1. Обчисліть масову частку Кальцію в кальцій оксиді СаО.
1. Робимо короткий запис умови задачі, у якому вказуємо, що відомо за умовою та що потрібно обчислити.

2. Обчислюємо відносну молекулярну масу сполуки:
Мr (СаО) = Аr (Са) + Аr (О) = 40 +16 = 56.
3. Обчислюємо масову частку Кальцію за формулою
W =  ;
;
W (Ca) =  = 0,714 або 71,4%.
= 0,714 або 71,4%.
Відповідь: w = 0,714 (або 71,4 %).
Задачі можуть бути складнішими, з обчисленням масових часток усіх елементів у сполуці.
Задача 2. Обчисліть масові частки елементів у кальцій хлориді СаСl2.

Розв’язання
Перший спосіб
1. Мr (СаСl2) = Ar (Са) + 2Аr (Сl) = 40 + 2 ∙ 35,5 = 111.
2. w (Ca) =  ; w (Ca) =
; w (Ca) =  = 0,36 або 36 %.
= 0,36 або 36 %.
3. w (Cl) =  = 0,64 або 64%.
= 0,64 або 64%.
Відповідь: w(Ca) = 0,36 або 36 %; w(Cl) = 0,64 або 64 %.
Другий спосіб
1. Мr (СаСl2) = Ar (Са) + 2Аr (Сl) = 40 + 2 ∙ 35,5 = 111.
2. w (Ca) =  ;
;
W (Ca) =  = 0,36 або 36 %.
= 0,36 або 36 %.
3. w (Сl) = 1 – 0,36 = 0,64 або 64 %.
Відповідь: w(Ca) = 0,36, або 36 % w(Cl) = 0,64 або 64 %.
Задача 3. Обчисліть масові частки елементів у кальцій карбонаті СаСО3.
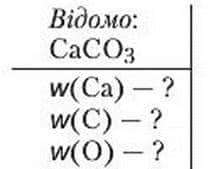
Розв’язання
1. Мr (СаСО3) = Аr (Са) + Ar (С) + ЗАr (О) = 40 + 12 + 3 ∙ 16 = 100.
2. w (Ca) =  ;
;
W (Ca) =  = 0,4 або 40%.
= 0,4 або 40%.
3. w(Ca) =  = 0,12 або 12 %.
= 0,12 або 12 %.
4. w(O) = 1 – (0,4 + 0,12) = 0,48 або 100 % – (40 % + 12 %) = 48 %.
Відповідь: w(Ca) = 0,4 або 40 %; w(C) = 0,12 або 12 %; w(О) = 0,48 або 48 %.
ЦІКАВО ЗНАТИ
Як знайти формулу за масовою часткою?
За масовими частками елементів можна знайти хімічну формулу сполуки.
Задача 4. До складу речовини входять: Карбон – 75 % і Гідроген – 25 %. Знайдіть хімічну формулу сполуки.

Розв’язання
1. Позначимо число атомів Карбону в сполуці х, а Гідрогену – у.
2. Уважатимемо, що є 100 г речовини. Тоді маса атомів Карбону становить 75 г; а маса атомів Гідрогену – 25 г.
3. Знаходимо число атомів Карбону й Гідрогену. Для цього їх масу поділимо на відповідні відносні атомні маси кожного з елементів:
X : y =  :
: 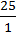 ; x : y = 6,25 : 25.
; x : y = 6,25 : 25.
4. Якщо відношення між атомами виражене не цілими, а дробовими числами, то менше число беремо за одиницю, а більше число ділимо на нього:
X : y =  :
: 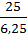 = 1 : 4.
= 1 : 4.
Отже, у молекулі сполуки кожний атом Карбону сполучений із чотирма атомами Гідрогену. Формула сполуки – СН4.
Відповідь: СH4.
Уміння визначати відносні молекулярні маси має велике особистісне значення. Ви зможете надалі вести хімічні
Розрахунки, набудете здатності використовувати ці вміння не тільки на уроках хімії, а й у фізиці, математиці або в майбутній професії.
ПІДСУМОВУЄМО ВИВЧЕНЕ
– Відносна молекулярна маса – це число, яке показує, у скільки разів маса певної молекули більша від 1/12 маси атома Карбону-12. Обчислюють її за сумою відносних атомних мас усіх елементів, що входять до складу структурних частинок речовини. “Відносну формульну масу” позначають так само, як і молекулярну, – Мr.
– Масова частка елемента – це відношення маси елемента до маси сполуки. Обчислюють її за формулою
W(E) =  або w(E) =
або w(E) =  ∙ 100%.
∙ 100%.
Є величиною відносною, тому безрозмірною, і виражається в частках від одиниці або відсотках.
ЗАВДАННЯ ДЛЯ КОНТРОЛЮ ЗНАНЬ
1. Обчисліть відносні молекулярні (формульні) маси сполук:
А) O3, FeO, CO, CuS, FeS2, NaOH, ZnCl2, NaBr, AlP, BaCr2, NH3, NO2, NaNO3, Ca3N2;
Б) Al2O3, CrSO4, ВаСO3, AlPO4, Cu(OH)2,Mg3N2, Fe3O4, CaCO3, BaSO4, Cr(OH)3;
В) Al(NO3)3, Mg3(PO4)2, Cr2(SO4)3, (NH4)2SO4, Cr(NO3)2, (NH4)2HPO4, Hg(NO3)2, Cr2(SiO3)3.
2. Обчисліть масові частки елементів у сполуках:
А) SО2, ZnO, MgS, FeS2, СаСl2, FeO, NO2, H2S, K2O, H2O, BaO;
Б) Fe2O3, H2O2, C2H6, Mg3N2, SO3, P2O5, Cr2O3, Al2S3, B2O3;
В) CuSO4, Ca3(PO4)2, Fe2(SO4)3, (NH4)3PO4,К2СO3, MgCO3, NaHSO4.
3. Визначте, у якому з оксидів масова частка елемента, сполученого з Оксигеном, є більшою:
A) Fe2O3і Fe3O4; б) СrО і СrO3; в) SO2 і SO3.
4. Обчисліть масу Силіцію у силіцій(ІV) оксиді SiO2 масою 240 г.
5. Обгрунтуйте, яке значення мають математичні обчислення за хімічною формулою для розуміння міжпредметних зв’язків.


