ТЕМА 1. ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ
Урок 5. Багатоманітність речовин. Прості й складні речовини. Метали й неметали. Хімічні формули речовин
Цілі: пояснити причину багатоманітності речовин, дати поняття “прості речовини”, “складні речовини”, “хімічна формула”; вивчити поділ простих речовин на метали й неметали; навчитися розрізняти прості й складні речовини, метали й неметали; розвивати вміння й навички учнів описувати фізичні властивості речовин і порівнювати їх; виховувати інтерес до вивчення хімії на основі
Обладнання: моделі атомів, зразки металів і неметалів, інші речовини – цукор, кухонна сіль, калій перманганат та ін.
Тип уроку: вивчення нового матеріалу (додатковий об’єм).
Форми роботи: лекція з елементами бесіди, інтелектуальна розминка, робота в парах (взаємоопитування), “Мікрофон”, експеримент – робота в групах.
ХІД УРОКУ
I. Організація класу
II. Оголошення теми й мети уроку
III. Актуалізація опорних знань
1. Інтелектуальна розминка
Учні самостійно формулюють основні поняття попередньої теми й дають їм визначення, один з учнів записує
– атом;
– молекула;
– іон;
– хімічний елемент;
– відносна атомна маса;
– період;
– група.
Упродовж уроку на дошці будуть дописуватися ще нові поняття:
– прості речовини;
– складні речовини;
– хімічна формула;
– метали;
– неметали.
2. Взаємоопитування
Учні працюють у парах, перевіряючи вміння визначати положення елементів у ПС і, навпаки, за положенням визначати елемент. Кожний з учнів ставить по два питання сусіду. Потім учні перевіряють одне одного в умінні знаходити відносні атомні маси.
3. Опитування-естафета
З метою перевірки вчитель може провести опитування-естафету за періодичною системою.
IV. Мотивація навчальної діяльності
Учням пропонується математичне завдання: користуючись цифрами 1, 2, 3, утворити різні одно-, дво-, трицифрові числа. Після 1 хв. роботи в учнів утвориться багато чисел. Відразу ж ставимо питання: мало чи багато речовин можна утворити зі 118 хімічних елементів? Звичайно, учні відповідатимуть, що багато. Ось цим і пояснюємо багатоманітність речовин – близько 20 000 000 речовин. Ще можна навести приклад з буквами: із 33 букв утворюються всі слова, якими ми користуємось у повсякденному житті.
V. Вивчення нового матеріалу
1. Поняття “хімічна формула”, “індекс”
Склад кожної речовини можна записати з допомогою символів хімічних елементів. Наприклад, молекула води складається з одного атома Оксигену і двох атомів Гідрогену. Малюють її так:
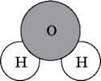
Записати хімічну формулу води можна так:
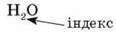
Вводимо поняття “хімічна формула” й “індекс”.
2. Прості та складні речовини
Демонстрація
Учням демонструємо зразки різних речовин, добре їм знайомі, на дошці вчитель записує формули цих речовин: цукор – C12H22O11, кухонна сіль – NaCl, марганцівка – KMnO4, цинк – Zn, алюміній – Al, сірка – S. Можна згадати, що до складу повітря входять кисень і азот – O2 і N2.
Перед учнями ставимо проблемне питання: Чим відрізняються ці речовини? Учні правильно відмітять, що за складом. Даємо поняття “прості” й “складні речовини”, складаємо схему і пропонуємо учням самостійно розподілити речовини на прості й складні. Схема заповнюється поступово: спочатку ділимо речовини на прості й складні, а потім доповнюємо поділ простих речовин на метали й неметали.

3. Метали й неметали
Далі згадуємо з учнями, що кожна речовина має свої фізичні властивості: колір, запах, агрегатний стан, блиск тощо.
Лабораторний дослід
Виконується у групах: кожній групі роздається набір із трьох речовин – цинк, сірка, алюміній.
Завдання: описати фізичні властивості пропонованих речовин; дати відповідь на питання: “За якими ознаками відрізняються ці речовини?”
Учні з’ясовують, що для металів характерний металічний блиск. Отже, прості речовини поділяються на метали й неметали. Дописуємо у схему окремо метали й неметали з наведених на дошці.
VI. Закріплення вивченого матеріалу
1. “Мікрофон”
Учні по черзі передають одне одному уявний мікрофон і дають визначення вивченим поняттям, які дописані по ходу уроку на дошці, доповнюють одне одного.
2. Міні-тренінг
Записати формули речовин, які складаються:
А) із двох атомів Калію й одного атома Оксигену;
Б) трьох атомів Оксигену;
В) одного атома Феруму;
Г) шести атомів Карбону, дванадцяти атомів Гідрогену й шести атомів Оксигену;
Д) одного атома Сульфуру і трьох атомів Оксигену;
Е) одного атома Алюмінію.
У два стовпчики виписати окремо прості й складні речовини.
VII. Домашнє завдання
