Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ОКСИГЕН. СУЛЬФУР
Оксиди Сульфуру
Фізичні властивості оксидів Сульфуру
Сульфур(ІV) оксид, або сульфур діоксид, або сірчистий ангідрид, – це безбарвний газ із характерним різким запахом. Саме він створює запах при згоранні сірників. При температурі -10 °С він скраплюється в безбарвну рідину, а при температурі -75 °С кристалізується. Добре розчиняється у воді: до 40 об’ємів газу в одному об’ємі води. Змішується з етером,
Сульфур(VІ) оксид, або сульфур триоксид, або сірчаний ангідрид, утворює кілька алотропних модифікацій. Одна з них, γ-SO3, являє собою безбарвну рідину, з температурою кипіння +45 °С та температурою кристалізації -17 °С. У твердому стані ця модифікація схожа на лід. Інша модифікація – α-SO3 – кристалічна речовина, схожа на азбест, що плавиться при температурі +40 °С. Необмежено розчиняється у воді. Добре розчиняється в сульфатній кислоті. Розчин сульфур триоксиду в сульфатній кислоті називають олеумом.
Хімічні властивості оксидів Сульфуру
Реакції
Ангідриди кислот – це речовини, які при взаємодії з водою утворюють відповідну кислоту. Таким чином, SO2 та SO3 – це ангідриди сульфітної та сульфатної кислот, відповідно:

Обидві речовини є кислотними оксидами, тобто реагують із основами:

З основними оксидами:

При розчиненні SO3 у сульфатній кислоті утворюється олеум:
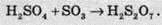
Олеум – це важливий продукт хімічної промисловості. Його використовують у виробництві лакофарбових та гумо-технічних виробів, для очищення нафти.
Сульфітна кислота
Сульфітна кислота є дуже нестійкою й існує тільки у водному розчині. При виділенні з розчину вона розкладається на сульфітний ангідрид та воду.
Сульфітна кислота досить слабка (Ка1 = 2 ∙ 10-2, Ка2 = 6 ∙ 10-8). Дисоціація кислоти відбувається за такою схемою:

Сульфітна кислота утворює два ряди солей: середні (сульфіти) та кислі (гідрогенсульфіти). При нагріванні сульфіти лужних і лужноземельних металів диспропорціонують:

Сульфіти менш активних металів розкладаються на оксиди:

Більш сильні кислоти легко витісняють її із солей і розкладають на сульфур діоксид та воду:
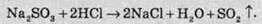
Сульфіти лужних металів при сплавлянні із сіркою утворюють нову сполуку – тіосульфат:

Різниця між сульфатом і тіосульфатом полягає в тому, що один з атомів Оксигену сульфат-іона замінений атомом Сульфуру. Виходить, що в iоні тіосульфату один атом Сульфуру перебуває в ступені окиснення +6, а інший у ступені окиснення -2.
Реакції зі зміною ступеня окиснення
При нагріванні суміші сульфур(ІV) оксиду та кисню над каталізатором ванадій(V) оксидом V2O5 можна добути сульфур(VІ) оксид:

Сульфітна кислота и сульфур діоксид легко окислюються сильними окисниками:
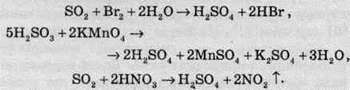
Останню реакцію використовують у промисловості при нітрозному методі добування сульфатної кислоти.
Добування й застосування сульфур оксидів
Добування сульфур(І V ) оксиду
У промисловості сульфітний ангідрид добувають як побічний продукт при виплавці заліза, спалюванням на повітрі піриту (FeS2):

Найпростіше сульфур діоксид можна добути з елементів при спалюванні простої речовини сірки на повітрі:

При дії сильних кислот на сульфіти металів:

При взаємодії концентрованої сульфатної кислоти з неактивними металами:

Добування сульфур( V І) оксиду
Сульфур(VІ) оксид, необхідний для добування сульфатної кислоти, у XIX столітті в основному добували нітрозним методом, який грунтувався на реакції:
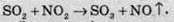
Сьогодні найпоширенішим методом окиснення сульфітного ангідриду в сульфатний є контактний метод, який полягає в окисненні повітрям з каталізатором ванадій(V) оксидом V2O5.

Застосування сульфур(І V ) оксиду та сульфітів
Велику частину добутого сульфур(ІV) оксиду використовують для виробництва сульфатної кислоти. Сульфітний ангідрид є добрим відновником, за рахунок чого він здатний відновлювати деякі природні й штучні барвники. Цю властивість сульфітного ангідриду застосовують у текстильній промисловості для вибілювання різних матеріалів, наприклад шовку, вовни та соломи. Сульфур(ІV) оксид знешкоджує різні бактерії й мікроорганізми, тому його також використовують для дезінфекції сирих приміщень.
Кальцій гідрогенсульфіт застосовують при так званому сульфітному варінні целюлози, задля того, аби надати їй певних якостей. У такий спосіб обробляють деревину та папір.
Натрій сульфіт використовують як проявник у фотографії.
Застосування сульфур( V І) оксиду
Цю сполуку використовують для виробництва сульфатної кислоти та олеуму.

 (2 votes, average: 4,00 out of 5)
(2 votes, average: 4,00 out of 5)