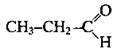ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ
12. Оксигеновмісні органічні сполуки
12.3. Альдегіди
Альдегідами називають органічні речовини, молекули яких містять альдегідну групу  (R – алкільний замісник). Загальна формула – СпН2n+1СНО або СпН2nО. Остання формула правильна і для альдегідів, і для їхніх міжкласових ізомерів – кетонів. І ті, й інші мають однакову функціональну (карбонільну) групу –
(R – алкільний замісник). Загальна формула – СпН2n+1СНО або СпН2nО. Остання формула правильна і для альдегідів, і для їхніх міжкласових ізомерів – кетонів. І ті, й інші мають однакову функціональну (карбонільну) групу –  і, відповідно, подібні властивості.
і, відповідно, подібні властивості.
 в альдегідів – з алкільним замісником і атомом Гідрогену:
в альдегідів – з алкільним замісником і атомом Гідрогену:  (перший член гомологічного ряду – метаналь – з двома атомами Гідрогену
(перший член гомологічного ряду – метаналь – з двома атомами Гідрогену  ).
).Будова, ізомерія, номенклатура аліфатичних альдегідів
Атом Карбону утворює три σ-зв’язки, розміщені в одній площині під кутом 120° один до одного. Атоми Карбону й Оксигену перебувають у стані sp2-гібридизації, і σ-зв’язок між ними утворюється за рахунок перекривання гібридизованих електронних хмар.

Класифікація альдегідів
Аліфатичні |
|
Аліциклічні |
|
Ароматичні |
|
Гомологічний ряд аліфатичних альдегідів
Молекулярна Формула Альдегіду | Скорочена структурна формула альдегіду | Назва альдегіду | |
Міжнародна | Тривіальна (традиційна) | ||
НСНО |
| Метаналь | Формальдегід (мурашиний альдегід) |
СН3СНО |
| Етаналь | Ацетальдегід (оцтовий альдегід) |
С2Н5СНО |
| Пропаналь | Пропіловий альдегід |
С3Н7СНО |
| Бутаналь | Масляний альдегід |
С4Н9СНО |
| Пентаналь | Валеріановий альдегід |
С5Н11НО |
| Гесканаль | Капроновий альдегід |
Фізичні властивості аліфатичних альдегідів
Метаналь – газ, наступні гомологи до 14-го члена – рідини, починаючи від С15Н31СНО – тверді речовини. Альдегіди добре розчинні у воді й органічних розчинниках. Метаналь – отруйний задушливий газ із різким специфічним запахом, подразнює шкіру і слизові оболонки. Етаналь – летка рідина, добре розчинна у воді та органічних розчинниках.
Температури плавлення і кипіння альдегідів нижчі, ніж у відповідних спиртів, але значно вищі, ніж в алканів із тою ж молекулярною масою.
Хімічні властивості альдегідів
Хімічні властивості альдегідів зумовлені наявністю в їхніх молекулах карбонільної групи. Полярність карбонільного зв’язку робить легким приєднання полярних реагентів. Також для альдегідів характерні реакції приєднання за рахунок розриву π-зв’язку.
Приєднання водню |
| Реакція відновлення: утворюються первинні спирти |
| При окисненні киснем повітря, КМnO4, К2СrO4, Сu(ОН)2, реактивом Толленса1 утворюються карбонові кислоти | |
Часткове |
| Часткове окиснення купрум(ІІ) гідроксидом або реактивом Толленса – якісна реакція на альдегіди |
Окиснення |
| Реакція “срібного дзеркала” – якісна реакція на альдегіди |
Повне |
| Горіння |
| Особливості окиснення мурашиного альдегіду | |
Заміщення |
| Реакція заміщення α-гідрогенових атомів: послідовно утворюються моно-, ди – та трихлороцтовий альдегіди |
Поліконденсація |
| |
Полімеризація |
| |
1 Реактив Толленса – аміачний розчин аргентум(І) оксиду – OH.
Добування альдегідів
І. Загальні методи одержання
1. Окиснення первинних спиртів:

У загальному вигляді (схематично):

2. Гідроліз гемінальних дигалогенопохідних1:

3. Каталітичне дегідрування первинних спиртів:

4. Каталітичне окиснення алкенів:

II. Добування окремих представників альдегідів
1. Етаналь добувають гідратацією ацетилену (реакція Кучерова):

2. Каталітичне окиснення етилену киснем (каталізатор – солі Купруму, Феруму, Паладію):

3. Формальдегід добувають каталітичним окисненням метану:

Застосування альдегідів
Метаналь є сировиною для виробництва: фенолформальдегідних смол і пластмас, одержаних з них (фенопластів), ypoтропіну(CH2)6N4, який використовують як лікарський засіб і з якого виготовляють вибухівку. У вигляді формаліну2 застосовують для бальзамування і консервації біологічного матеріалу, дублення шкіри, як антисептик.
Етаналь використовують для добування етанолу, оцтової кислоти, бутадієну та низки інших органічних речовин.
__________________________________________________________________
1 Гемінальні дигалогенопохідні – дигалогенопохідні вуглеводнів, у яких обидва атоми галогену розташовані біля одного атома Карбону.
2 Формалін – водний розчин формальдегіду з масовою часткою метаналю 40 %, який містить 8 % метанолу (для стабілізації).