Тема 2
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
УРОК 39
Тема. Тематичне оцінювання з теми “Основні класи неорганічних сполук”
Цілі уроку: узагальнити й систематизувати знання учнів з теми “Основні класи неорганічних сполук”; визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Тип уроку: контроль і коригування знань, умінь і навичок.
Форми роботи: письмова контрольна робота за варіантами.
Обладнання: Періодична система хімічних
ХІД УРОКУ
I. Організація класу
II. Письмова контрольна робота
Учитель нагадує учням зміст завдань, час виконання, розподіляє варіанти, називає ключові моменти оформлення відповідей й систему оцінювання:
– завдання 1-6 – тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань дають 3 бали;
– завдання 7-9 оцінюються по 2 бали, разом за дев’ять правильно виконаних завдань – 9 балів;
– завдання 10 пропонується виконувати учням, які претендують на оцінку 12 балів, оцінюється у 3 бали.
Таким чином, максимальна оцінка за правильно
Час на виконання роботи – 40 хв.
Варіант І
1. Укажіть рівняння реакції, що є якісною реакцією на хлоридну кислоту та її солі:

2. Укажіть ряд, у якому наведено формули сульфатів:
А) CaSO4, Na2SO4, Al2(SO4)3;
Б) K2S; ZnS, MgS;
В) BaSO3, K2SO3, CaSO3.
3. Дано рівняння реакції:
NaCl + КОН 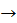 KCl + NaOH
KCl + NaOH
Ця реакція не можлива, тому що:
А) усі вихідні реагенти та продукти реакції розчинні;
Б) випадає осад;
В) змінюється колір розчину.
4. Маса купрум(ІІ) сульфату, що утворюється в результаті взаємодії сульфатної кислоти масою 9,8 г з надлишком лугу, дорівнює:
А) 10 г;
Б) 14 г;
В) 16 г.
5. Унаслідок взаємодії солей з кислотами утворюються:
А) нова сіль і нова кислота;
Б) основа й нова кислота;
В) нова сіль і основа.
6. З розчином купрум(ІІ) сульфату не реагують метали:
A) Mg, Zn, Fe;
Б) Na, К, Са;
В) Au, Pt, Ag.
7. На нейтралізацію калій гідроксиду витратили нітратну кислоту масою 18,9 г. Обчисліть масу солі, що утворилася.
8. Здійсніть перетворення:
S 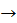 SO2
SO2 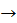 H2SO3
H2SO3 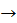 K2SO3
K2SO3 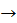 CaSO3
CaSO3
9. Складіть рівняння хімічних реакцій послідовних перетворень для одержання цинк оксиду із сульфатної кислоти.
10. Двовалентний метал масою 4 г розчинили у воді. При цьому виділився водень об’ємом 2,24 л (н. у). Визначте цей елемент.
Варіант II
1. Укажіть рівняння реакції, з допомогою якої можна одержати луг:

2. Укажіть пару солей, в якій обидві солі нерозчинні:
А) ВаСl2, NaNO3;
Б) КСl, Na2SiO3;
В) AgCl, BaSO4.
3. Дано рівняння реакції:
Cu + 2AgNO3 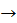 Cu(NO3)2 + 2Ag
Cu(NO3)2 + 2Ag
Ця реакція можлива, тому що:
А) менш активний метал витісняє з розчину солі більш активного металу;
Б) більш активний метал витісняє з розчину солі менш активного металу;
В) мідь реагує з нітратами.
4. У результаті взаємодії аргентум(І) нітрату масою 17 г із хлоридною кислотою випадає осад масою:
А) 12,5 г;
Б) 14 г;
В) 14,35 г.
5. Унаслідок сильного нагрівання нерозчинних у воді основ утворюються:
А) нова основа й вода;
Б) луг і вода;
В) оксид і вода.
6. Гідроксиди складу Ме(ОН)3 утворюються металами:
А) Аl, Fe, Сr;
Б) Na, Mg, Са;
В) К, Zn, Ag.
7. Який об’єм газу (н. у.) виділиться в результаті остаточного розчинення кальцій карбонату масою 20 г у хлоридній кислоті?
8. Здійсніть перетворення:

9. Складіть рівняння хімічних реакцій послідовних перетворень для одержання ортофосфатної кислоти з фосфору.
10. Двовалентний метал масою 1,2 г без залишку розчинився в хлоридній кислоті. При цьому витратилася кислота масою 3,65 г. Визначте цей елемент.
Варіант III
1. Укажіть рівняння реакції нейтралізації:

2. Укажіть пару формул, до якої входять лише амфотерні гідроксиди:
A) NaOH, Ва(ОН)2;
Б) Са(ОН)2, Сr(ОН)3;
В) Zn(OH)2, Аl(OН)3.
3. Дано рівняння реакції:
MgCl2 + 2NaOH 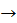 2NaCl + Mg (OH)2
2NaCl + Mg (OH)2
Ця реакція можлива, тому що:
А) виділяється газ;
Б) випадає осад;
В) утворюється вода.
4. У результаті взаємодії міді масою 64 г з розчином аргентум(І) нітрату випадає в осад срібло масою:
А) 216 г;
Б) 21,6 г;
В) 20 г.
5. Колір лакмусу в лужному середовищі:
А) червоний, не змінюється;
Б) синій, рожевий;
В) синій, малиновий.
6. З наведених пар сполук виберіть ті, в яких обидві речовини реагуватимуть із цинк гідроксидом:
А) Н2O, ZnO;
Б) HNO3, NaOH;
В) H2S, MgO.
7. Який об’єм газу виділиться (н. у.), якщо нагрівати за високої температури магній карбонат масою 336 г?
8. Здійсніть перетворення:

9. Складіть рівняння хімічних реакцій послідовних перетворень для одержання купрум(ІІ) хлориду з міді.
10. Тривалентний метал масою 11,2 г прореагував із хлором. При цьому витратився хлор об’ємом 6,72 л (н. у). Визначте цей елемент.
III. Домашнє завдання
Повторити з курсу фізики й хімії за 7 клас будову атома.


