Хімія – універсальний довідник
ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ
СУЛЬФАТНА КИСЛОТА ТА ЇЇ СОЛІ
У творений при окисненні діоксиду сульфуру триоксид сульфуру – кислотний оксид. Під час його взаємодії з водою утворюється сульфатна кислота Н2SO4:

Безводна сульфатна кислота – рідина, густина якої майже у два рази перевищує густину води. Вона змішується з водою у будь-яких пропорціях. Процес розчинення супроводжується виділенням великої кількості тепла, що свідчить про утворення з водою хімічних сполук.
Сульфатна
У розбавлених розчинах сульфатна кислота виявляє усі типові властивості кислот. Вона забарвлює у відповідний колір індикатори, дисоціюючи з утворенням іонів Гідрогену:

При цьому по першому щаблеві сульфатна кислота дисоціює необоротно, а по другому – оборотно.
Сульфатна кислота взаємодіє з металами, які стоять у ряді напруг лівіше Гідрогену, з основними оксидами, з основами, а також із солями, наприклад:

У таблиці на с.
Таблиця
Сірка та її сполуки
Сірка | Сполуки cульфуру | |
Оксиди сульфуру | Сульфатна кислота | |
1. За звичайних умов – жовта кристалічна речовина. 2. Горить у кисні:
(проявляє відновні властивості) 3. Взаємодіє з металами і воднем:
(проявляє окисні властивості) У природі зустрічається Самородна сірка S, Сульфіди FеS2 (пірит), СuS; Сульфати СаSО1 – 2Н20 (гіпс), Nа2SO4 | 1. За звичайних умов SO2 – газ, SO3 – тверда речовина 2. Проявляють властивості кислотних оксидів, взаємодіючи з водою:
З лугами:
З основними оксидами:
Одержання 1) оксиду сульфуру (IV) у промисловості: Горіння сірки
Випалювання піриту
В лабораторії:
2) оксиду сульфуру (VI) у промисловості: Каталітичне окиснення оксиду сульфуру (IV)
| 1. За звичайних умов безбарвна важка (ρ ≈ 2 г/см ) рідина, необмежено розчинна у воді 2. Сильна двохосновна кислота:
3. Взаємодіє з металами:
Концентрована кислота пасивує Аl і Fе 4. Взаємодіє з лугами, основами і амфотерними гідроксидами:
5. Взаємодіє з основними і амфотерними оксидами:
6. Концентрована кислота гігроскопічна:
Одержання у промисловості:
|
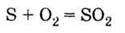
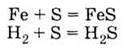




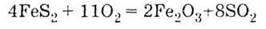









 (2 votes, average: 4,50 out of 5)
(2 votes, average: 4,50 out of 5)