КИСЛОТИ Й ОСНОВИ
3. Нейтралізація
3.2. Титрування кислот і основ
Проведення титрування
Для визначення концентрації кислоти або лугу потрібне таке приладдя:
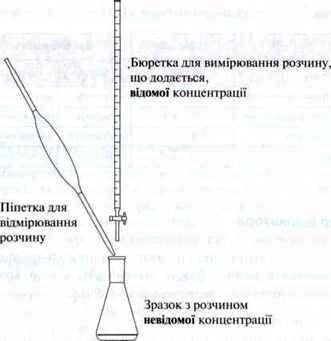
– піпетка для відмірювання певного об’єму кислоти або основи невідомої концентрації;
– бюретка для вимірювання розчину відомої концентрації;
– Колба Ерленмейера (зі зразком) для розміщення відміряного об’єму розчину, що визначається, невідомої концентрації.
Після додавання відповідного індикатора для титрування
Приклад. Етанову кислоту з невідомою концентрацією титрують 0,1-М-розчином їдкого натру в присутності фенолфталеїну як індикатора.
Відомі величини:
– концентрація розчину їдкого натру (лугу): сЛ = 0,1 моль/л;
– використаний об’єм розчину їдкого натру: VЛ = 25 мл;
– відміряний об’єм етанової кислоти: VK = 10 мл.
Розрахунок концентрації ск:
– витрачена хімічна кількість їдкого натру в розчині:
NЛ = сл ∙
Оскільки в розчині їдкий натр продисоціював повністю, то ця хімічна кількість відповідає використаній хімічній кількості гідроксид-іонів. Вони у свою чергу вступають у реакцію з такою самою хімічною кількістю іонів гідроксонію, які утворюються з такої ж хімічної кількості етанової кислоти. Тому:

Використовуючи молярну масу етанової кислоти, можна розрахувати також масову концентрацію – титр (Т):
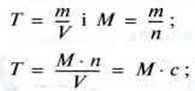
М (етанова кислота) = 60 г/моль;
Т = 60 г/моль ∙ 0,25 моль/л = 15 г/л.
