ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 10. ПІДГРУПА НІТРОГЕНУ
§ 10.1. Загальна характеристика підгрупи нітрогену
Підгрупу нітрогену складають п’ять елементів: нітроген, фосфор, стибій, арсен і бісмут. Це р-елементи V групи періодичної системи Д. І. Менделєєва. На зовнішньому енергетичному рівні їх атоми мають по п’ять електронів – ns2 nр3 (п. 2, табл. 10.1). Тому найвищий ступінь окиснення цих елементів дорівнює +5, найнижчий -3, характерний також +3.
Таблиця 10.1. Властивості
Властивості | N | Р | As | Sb | Ві |
1. Порядковий номер | 7 | 15 | 33 | 51 | 83 |
2. Валентні електрони | 2s22p3 | 3s23p3 | 4s24p3 | 5s25p3 | 6s26p3 |
3. Енергія іонізації атома, еВ | 14,5 | 10,5 | 9,8 | 8,6 | 7,3 |
4. Відносна електро негативність | 3,07 | 2,1 | 2,2 | 1,82 | 1,67 |
5. | +5,+4, +3,+2, +1,-3, -2,-1 | +5,+4, +3,+ 1, -3,-2 | +5,+3, -3 | +5,+3, -3 | +5,+3, -3 |
6. Радіус атома, нм | 0,071 | 0,13 | 0,15 | 0,16 | 0,18 |
На прикладі нітрогену і фосфору розглянемо валентні стани елементів. Електронна будова зовнішніх енергетичних рівнів їх атомів така:
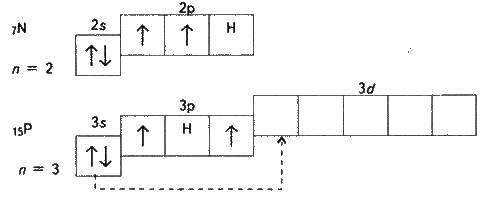
У атома нітрогену є три неспарених електрони. Тому валентність нітрогену дорівнює трьом. Оскільки нітроген не має на зовнішньому рівні d-підрівня, то його електрони розпаровуватись не можуть. Однак атом нітрогену може віддати із 2s-підрівня один електрон іншому електронегативному атому, тоді він набуде заряду (N) і матиме чотири неспарених електрони, тобто стане чотиривалентним. Це здійснюється, наприклад, в нітратній кислоті HNO3, де нітроген чотиривалентний. П’ятивалентним нітроген бути не може (див. § 3.10).
У атомів фосфору і наступних елементів підгрупи є вільні орбіталі на Зd-підрівні, а тому, переходячи у збуджений стан, будуть розпаровуватися 3s-електрони (вказано стрілкою).
Таким чином, у незбудженому стані всі елементи підгрупи нітрогену мають валентність три, у збудженому – всі, крім нітрогену, мають валентність п’ять.
З гідрогеном елементи підгрупи нітрогену утворюють сполуки типу RH3. Молекули RH3 мають пірамідальну форму (див. рис. 3.4). У цих сполуках зв’язки елементів з гідрогеном значно міцніші, ніж у відповідних сполуках елементів підгрупи оксигену і особливо підгрупи галогенів. Тому водневі сполуки елементів підгрупи нітрогену у водних розчинах не утворюють іонів гідрогену.
З оксигеном елементи підгрупи нітрогену утворюють оксиди загальної формули R2O3 і R2O5. Оксидам відповідають кислоти HRO2 та HRO3 (і ортокислоти H3RO4, крім нітрогену). В межах підгрупи характер оксидів змінюється так: N2O3 – кислотний оксид; Р4О6 – слабкокислотний оксид; AS2O3 – амфотерний оксид з переважанням кислотних властивостей; SbО3 – амфотерний оксид з переважанням основних властивостей; Вl2О3 – основний оксид. Отже, кислотні властивості оксидів складу R2O3 та R2O5 зменшуються зі зростанням порядкового номера елемента (п.1, табл. 10.1).
Як видно з п. З і 6 табл. 10.1, у підгрупі зі зростанням порядкового номера неметалічні властивості слабшають, а металічні посилюються. Цим пояснюється зменшення міцності водневих сполук RH3 від NH3 до ВiН3, а також зменшення міцності кисневмісних сполук у зворотному порядку.
Дуже різні властивості першого та останнього елементів підгрупи: нітроген – неметал (х = 3,07), бісмут – метал (х = 1,67). Проте, як свідчать дані табл. 10.1, перехід від першого до останнього здійснюється закономірно зі зростанням заряду ядра атома і порядкового номера елемента.
