Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ
Класифікація за тепловим ефектом
За тепловим ефектом реакції належать або до екзотермічних (реакції з виділенням теплоти) або до ендотермічних (реакції з поглинанням теплоти).
Тепловий ефект хімічної реакції. Термохімічні рівняння
Велика кількість хімічних процесів відбувається з виділенням енергії, зокрема горіння (реакція, що відбувається з виділенням теплоти й світла). Існує й чимало
Є реакції, в яких теплота поглинається. їхнє здійснення потребує нагрівання. До таких реакцій належать реакції розкладу гідроксидів, оксигеновмісних кислот, їхніх солей, кристалогідратів:
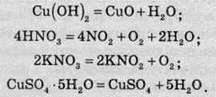
Якщо припинити нагрівання, то припиняється й реакція. З іншого боку, реакції, які протікають із виділенням теплоти, часто відбуваються мимовільно. Щоправда, у більшості випадків їх треба ініціювати (наприклад, підпалити речовину), після чого вони будуть проходити без сторонньої допомоги.
Усі реакції відбуваються з певним
Реакції, в яких теплота виділяється, називають екзотермічними, а реакції, в яких теплота поглинається,- ендотермічними.
Показати виділення або поглинання теплоти можна в хімічному рівнянні:
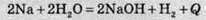
(“+Q” означає, що теплота виділяється);
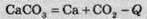
(“-Q” означає, що теплота поглинається).
Причина виділення або поглинання теплоти під час хімічної реакції
Кожна речовина має свою внутрішню енергію, яку неможливо виміряти. Вона складається з енергій усіх частинок речовини – атомів, молекул, іонів та енергій хімічних зв’язків між ними. Енергія кожної частинки у свою чергу має кілька складників. Серед них – кінетична енергія, тому що частинка може рухатися, обертатися (якщо речовина є газом або рідиною) або коливатися (якщо речовина тверда), та енергія електронів в атомі. Якщо сумарна внутрішня енергія реагентів перевищує сумарну внутрішню енергію продуктів, то різниця енергії виділяється під час реакції у вигляді тепла, а якщо вона нижча, то відбувається поглинання теплоти. Різниця цих енергій і становить тепловий ефект реакції.
Тепловий ефект реакції залежить від кількох факторів. Один із них – це природа речовин, що беруть участь у реакції. Так, розклад нітроген(ІІ) оксиду відбувається з виділенням теплоти:
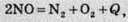
А меркурій(ІІ) оксиду – з поглинанням теплоти:
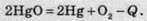
Другий фактор – це маса речовин. Чим більша маса речовин, тим більше виділяється або поглинається теплоти.
Якщо літеру “Q” замінити числовим значенням теплового ефекту, то ми одержимо термохімічне рівняння:
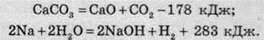
Записане в першому рівнянні значення теплового ефекту відповідає участі в реакції 1 моль кальцій карбонату й утворенню 1 моль кальцій оксиду й 1 моль карбон(ІV) оксиду.
Велика кількість реакцій, у разі зміни умов, можуть відбуватися в протилежних напрямках. Так, кальцій карбонат при нагріванні розкладається, а за звичайних умов відбувається зворотна реакція – кальцій оксид реагує з вуглекислим газом:
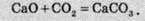
Ця реакція на відміну від ендотермічної реакції розкладання кальцій карбонату проходить із виділенням теплоти, тобто є екзотермічною. Значення її теплового ефекту буде таким самим, але з протилежним знаком:
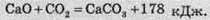
Тепловий ефект прямої реакції дорівнює тепловому ефекту зворотної реакції, але має протилежний знак.

 (2 votes, average: 4,00 out of 5)
(2 votes, average: 4,00 out of 5)