Тема 4
ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ
УРОК 66
Тема. Тематичне оцінювання з теми “Хімічний зв’язок і будова речовини”
Цілі уроку: узагальнити й скоригувати знання учнів з теми “Хімічний зв’язок і будова речовини”; визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Тип уроку: контролю й коригування знань, умінь і навичок.
Форми роботи: письмова контрольна робота за варіантами.
Обладнання: Періодична система хімічних
ХІД УРОКУ
I. Організація класу
II. Письмова контрольна робота
Учитель розподіляє варіанти, нагадує учням зміст завдань, час виконання і ключові моменти оформлення відповідей і систему оцінювання:
– завдання 1-6 – тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань – 3 бали;
– завдання 7-9 оцінюються по 2 бали, разом за дев’ять правильно виконаних завдань – 9 балів;
– завдання 10 пропонується виконувати учням, які претендують на оцінку 12 балів, оцінюється в 3 бали.
Отже, максимальна
Час на виконання роботи – 40 хв.
Варіант І
1. Ковалентним називають хімічний зв’язок, що утворюється:
А) іонами;
Б) спільною електронною парою;
В) іонами та спільною електронною парою.
2. Ступінь окиснення атома Оксигену в оксидах дорівнює:
А) -2;
Б) 0;
В) -1.
3. У вузлах іонних кристалічних граток розміщені:
А) позитивно заряджені іони металів;
Б) негативно заряджені іони неметалів;
В) позитивно заряджені іони металів і негативно заряджені іони неметалів.
4. Дано рівняння реакції:
Zn + 2НСl = ZnCl2 + Н2
У цій реакції окислюються:
А) Цинк;
Б) Гідроген;
В) Хлор.
5. Найбільш полярним є ковалентний зв’язок між атомами:
А) Н-Сl;
Б) H-S;
В) H-N.
6. Елемент з електронною формулою 1s22s22p63s23p3 виявляє відповідно максимальний і мінімальний ступені окиснення:
А) -3 і +5;
Б) +3 і +5;
В) +3 і -5;
Г) -3 і +3.
7. Визначте вид хімічного зв’язку і тип кристалічних граток у сполуках: N2, HF, NH3, СН4, H2S, КСl.
8. Визначте ступені окиснення атомів у сполуках: As2O5, SO3, NH3, Сl2O7, НСl, O2.
9. Допишіть рівняння реакцій, виберіть рівняння зі зміною ступеня окиснення атомів. Укажіть для цього рівняння окисник і відновник:
A) Cu + Hg(NO3)2 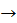
Б) СuО + HNO3 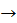
10. Елемент головної підгрупи II групи масою 3,6 г повністю прореагував під час нагрівання з азотом об’ємом 1,12 л (н. у.). Визначте цей елемент. Складіть схему будови атома, електронну формулу.
Варіант II
1. Іонним називають хімічний зв’язок, що утворюється:
А) електростатичним притяганням між іонами;
Б) спільною електронною парою;
В) іонами та спільною електронною парою.
2. Ступінь окиснення атомів у простих речовинах дорівнює:
А) +1;
Б) 0;
В) -1.
3. У вузлах молекулярних кристалічних граток розміщені:
А) неполярні або полярні молекули;
Б) атоми;
В) позитивно заряджені іони металів і негативно заряджені іони неметалів.
4. Дано рівняння реакції:
Cu + 2O2 = 2СuО
У цій реакції відновником є:
А) атом Оксигену;
Б) іон O-2;
В) атом Купруму.
5. Укажіть ряд, у якому наведені лише неполярні молекули:
A) N2, РН3, Н2;
Б) N2, O2, СO2;
В) N2, Н2O, NH3.
6. Елемент з електронною формулою 1s22s22p63s23p5 виявляє відповідно максимальний і мінімальний ступені окиснення:
А) +5 і -3;
Б) +5 і -1;
В) +7 і -1;
Г) +7 і +1.
7. Визначте вид хімічного зв’язку й тип кристалічних граток у сполуках: SO3, NCl3, ClF3, Br2, H2O, NaCl.
8. Визначте ступені окиснення атомів у сполуках: Mn2O7, СO2, РН3, SO2, Р2O5, H2Se.
9. Допишіть рівняння реакцій, виберіть рівняння зі зміною ступеня окиснення атомів. Укажіть для цього рівняння окисник і відновник:
A) Na + H2O 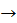
Б) NaOH + НСl 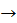
10. Оксид елемента головної підгрупи II групи масою 2,8 г повністю розчинився в хлоридній кислоті масою 3,65 г. Визначте цей елемент. Складіть схему будови атома, електронну формулу.
Варіант III
1. Речовина з молекулярною формулою F2 утворена хімічним зв’язком:
А) іонним;
Б) ковалентним полярним;
В) ковалентним неполярним.
2. Ступінь окиснення лужних металів у сполуках дорівнює:
А) +1;
Б) 0;
В) -1.
3. У вузлах атомних кристалічних граток розміщені:
А) полярні й неполярні молекули;
Б) атоми неметалів;
В) позитивно заряджені іони металів і негативно заряджені іони неметалів.
4. Дано рівняння реакції:
2HgO = 2Hg + О2
У цій реакції окисником є:
А) атоми Меркурію;
Б) іони Hg+2;
В) іони О-2.
5. Укажіть ряд, у якому наведено лише іонні сполуки:
А) КСl, ZnBr2, Аl2O3;
Б) HF, SO3, H2SO4;
В) K2SiO3, NO2, HBr.
6. Елемент з електронною формулою 1s22s22р63s23р2 виявляє відповідно максимальний і мінімальний ступені окиснення:
А) +2 і -2;
Б) +4 і -4;
В) +2 і -4;
Г) +4 і -2.
7. Визначте вид хімічного зв’язку й тип кристалічних граток у сполуках: СO2, РН3, Н2, OF2, O2, KF.
8. Визначте ступені окиснення атомів у сполуках: КВr, МnO2, Сr2O3, CaS, Al2S3, N2O5.
9. Допишіть рівняння реакцій, виберіть рівняння зі зміною ступеня
Окиснення атомів. Укажіть для цього рівняння окисник і відновник:
A) Fe2O3 + HCl 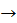
Б) Fe2O3 + H2 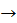
10. У реакції з елементом головної підгрупи III групи масою 5,4 г повністю прореагував хлор об’ємом 6,72 л (н. у.). Визначте цей елемент. Складіть схему будови атома, електронну формулу.


 (2 votes, average: 3,50 out of 5)
(2 votes, average: 3,50 out of 5)