ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
Атоми неметалічних елементів мають у зовнішньому енергетичному рівні (окрім енергетичних елементів) значну кількість електронів (від чотирьох до семи) і здатні приєднувати певну кількість електронів, а саме стільки, скільки їх не вистачає до октету.
Розгляньмо електронну будову атома Оксигену: 😯 1s22s22p4.
До завершення зовнішнього енергетичного рівня не вистачає двох електронів,
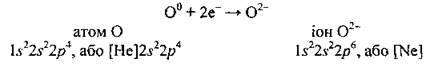
Розгляньмо ще один приклад: установимо, який йон може утворити атом Хлору.
Електронна формула Хлору – 17Сl 1s22s22p63s23p5.
У зовнішньому електронному шарі в атомі
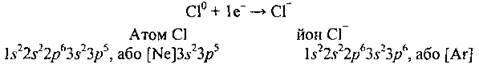
Радіуси атомів і відповідних аніонів майже однакові, тому що кількість енергетичних рівнів при утворенні негативно зарядженого йона залишається незмінною: 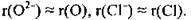
Отже, атоми неметалічних елементів здатні приєднувати електрони і перетворюватися на негативно заряджені йони – аніони.
9.1. Гідроген
Гідроген – 1-й елемент періодичної таблиці, заряд ядра – +1, належить до неметалічних s-елементів. Хімічний символ – Н, відносна атомна маса – 1. Електронна формула – 1s1.Валентність – І.
Природний Гідроген має два стабільні ізотопи: Протій – 1Н – і Дейтерій – 2D (2Н). Природного радіоактивного Тритію 3Т (3Н) на Землі всього близько 2 кг (він має космічне походження: при бомбардуванні атомів Нітрогену атмосфери швидкими нейтронами утворюється Карбон-12 і Тритій).
Молекула водню містить два атоми Гідрогену, які сполучені міцним ковалентним неполярним зв’язком. Він утворюється перекриванням двох 1s1 орбіталей обох атомів:
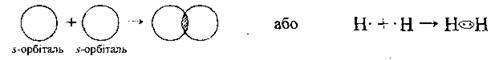
Гідроген за електронною будовою і здатністю утворювати катіони подібний до лужних металічних елементів. У результаті віддачі одного валентного електрона атом Гідрогену легко утворює позитивно заряджений йон, який називають протоном:
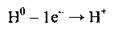
Атом Гідрогену, як і атоми галогенів, може приєднувати один електрон, завершуючи при цьому свій електронний шар. Утворюється негативно заряджений гідрид-йон:
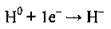
Отже, Гідроген виявляє ступінь окиснення +1, 0 і рідше -1:
Ступінь окиснення | -1 | 0 | + 1 |
Приклади сполук | КН, СаН2 | Н2 | H2O, КОН, Н2СO3, С2Н6 |
Поширеність Гідрогену в природі
Це найпоширеніший елемент Всесвіту – близько 92 % усіх атомів. На Землі Гідроген в основному трапляється у зв’язаному вигляді: входить до складу води (найважливіша природна сполука), нафти, вугілля, мінералів, гірських порід і всіх живих організмів. Кількість атомів Гідрогену в живих організмах становить близько 50 %. У вільному вигляді (проста речовина – водень) Гідроген трапляється у складі; повітря, інших природних та вулканічних газів, газів нафтових свердловин і в незначній кількості – в атмосфері (5 · 10-5 % загального об’єму).
9.1.1. Водень
Фізичні властивості
Водень Н2 – газ без кольору і запаху, погано розчинний у воді, однак добре розчинний у деяких металах (платині, паладії: один об’єм паладію розчиняє 900 об’ємів водню). Неотруйний. Вибухонебезпечний. Зріджується за температури -253 °С, а за температури -259 °С твердне. Твердий водень має молекулярні кристалічні гратки. Це найлегший з усіх відомих газів. Відносна молекулярна маса – 2. Молярна маса – 2 г/моль.
Добування водню
Лабораторні способи:
1. Взаємодія металів (Zn, Fe, Mg, Al) з хлоридною кислотою або із сульфатною розбавленою кислотою:
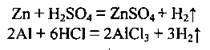
2. Електроліз води:
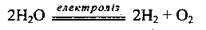
3. Взаємодія активних металів з водою:
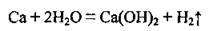
4. Взаємодія металів, яким відповідають амфотерні оксиди і гідроксиди, з лугами:
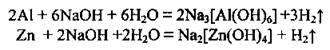
5. Електроліз розчинів хлоридів лужних металічних елементів:
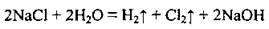
Збирають водень у посудину двома способами:
– витісненням повітря (пробірку розміщують дном догори);
– витісненням води (погано розчиняється у воді).
Промислові способи:
1. Каталітичне окиснення:
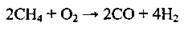
2. Конверсія (перетворення) метану з водяною парою:
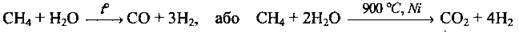
3. Крекінг вуглеводнів (метану):
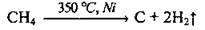
4. При взаємодії водяних парів з вугіллям (утворюється суміш карбон(ІІ) оксиду і водню, яку називають водяним газом):
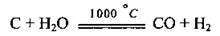
5. Залізопаровий спосіб:
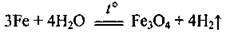
Перспективним є метод електролізу води:
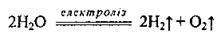
Хімічні властивості водню
За нормальних умов водень доволі малоактивний (реагує лише із фтором). Його реакційна здатність підвищується за наявності платини чи нікелю. Це пов’язано з тим, що водень розчиняється в цих металах і при цьому його молекули розпадаються на атоми. Атомарний Гідроген значно активніший за молекулярний водень. У хімічних реакціях водень зазвичай виступає як відновник, хоча може бути і окисником. Водень реагує:
1) з простими речовинами:
– виявляючи відновні властивості в реакціях з неметалічними елементами:
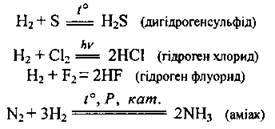
Суміш двох об’ємів водню й одного об’єму кисню надзвичайно вибухонебезпечна, її називають гримучим газом, або гримучою сумішшю:
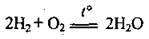
– виявляючи окисні властивості в реакціях з лужними та лужноземельними металами (утворює гідриди):
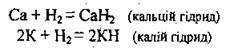
Гідриди – бінарні солеподібні йонні сполуки, які розкладаються водою і кислотами, а також окислюються киснем:
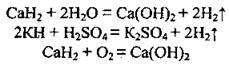
2) з оксидами металічних і неметалічних елементів за високої температури, відновлюючи їх:
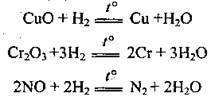
3) із чадним газом, утворюючи метанол (каталізатор – CuO, ZnO):
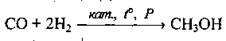
4) за стандартних умов з деякими солями малоактивних металічних елементів (Hg, Ag, Pd, Au), відновлюючи їх:
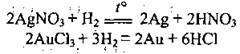
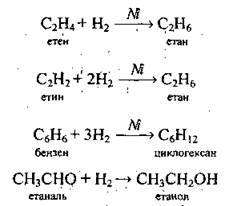
5) з органічними речовинами: алкенами, алкінами, аренами, алкадієнами, альдегідами, деякими жирами (реакції приєднання):
Застосування водню
Водень використовують для синтезу аміаку, хлороводню, органічних речовин; як відновник у металургії; у харчовій промисловості для гідрогенізації рослинних жирів; рідкий водень є ракетним паливом; киснево-водневим полум’ям ріжуть і зварюють метали.
Актуальним є вирішення в майбутньому проблеми застосування водню як екологічно чистого пального для автомобілів. Перспективним є також використання Дейтерію і Тритію для керованого термоядерного синтезу (КТС).
Найцікавішими бінарними сполуками Гідрогену є вода і гідроген пероксид.


