Тема 2
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
УРОК 34
Тема. Загальні способи одержання оксидів, основ, кислот, солей
Цілі уроку: розвивати вміння й навички учнів у складанні рівнянь на прикладі одержання оксидів, основ, кислот, солей; систематизувати знання учнів про загальні способи одержання оксидів, основ, кислот і солей; показати їх взаємозв’язок з генетичним зв’язком класів неорганічних сполук.
Тип уроку: узагальнення й систематизація знань учнів.
Форми роботи: семінар-практикум, демонстраційний
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, лабораторне устаткування, хімічні реактиви.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Мотивація навчальної діяльності
На попередньому уроці ми розглянули способи одержання оксидів, основ, кислот і солей. Удома ви склали схеми способів одержання класів неорганічних сполук.
(Учні презентують свої варіанти класифікації способів одержання класів неорганічних сполук. Учитель коментує й узагальнює.)
Тепер розглянемо, як практично
III. Практика на прикладах
Демонстрація 11. Взаємодія кальцій оксиду з водою
Насипаємо в пробірку кальцій оксид і доливаємо 10 мл дистильованої води.
– Що спостерігаємо? (Порошок розчинився)
– Що утворилося в пробірці? (Кальцій гідроксид)
– Як це можна підтвердити? (Індикатор фенолфталеїн забарвлює розчин у малиновий колір)
Записуємо рівняння хімічної реакції:
СаO + Н2O = Са(ОН)2
Тепер пропустимо вуглекислий газ крізь цей розчин.
– Що спостерігаємо? (Випадає осад, забарвлення зникає)
– Чому? (Утворилася сіль)
Записуємо рівняння реакції:
Са (ОН)2 + СO2 = CaCO3 + Н2O
+ Н2O
Завдання 1
Складіть ланцюжок перетворень, що відповідає нашому експерименту.
СаО 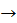 Са(ОН)2
Са(ОН)2 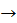 СаСo3
СаСo3
Демонстрація 12. Спалювання фосфору
Акуратно, під витяжкою спалюємо 0,5 г червоного фосфору. Одержаний білий порошок розчиняємо в 10-15 мл дистильованої води.
– Що утворилося в пробірці? (Ортофосфатна кислота)
– Як це можна перевірити? (З допомогою індикатора. Лакмус забарвлює розчин у рожевий колір)
Запишемо рівняння реакції.

Акуратно, по краплях, додаємо розчин натрій гідроксиду до зміни забарвлення розчину з рожевого на фіолетовий.
– Про що свідчить зміна забарвлення? (У пробірці немає кислоти, утворилася сіль)
Н3РO4 + 3NaOH = Na3PO4 + 3H2O
Завдання 2
Складіть схему перетворень, що відповідає цьому експерименту.
Р 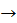 Р2O5
Р2O5 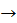 Н3РO4
Н3РO4 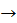 Na3PO4
Na3PO4
Завдання 3
Обчисліть масу натрій фосфату, який можна одержати з фосфору масою:
Варіант І – 6,2 г;
Варіант II – 15,5 г.
Клас розв’язує задачу та звіряє відповідь.
Завдання 4
Учитель пояснює на уроці, що для одержання солей можна скористатися такими способами:
А) реакція нейтралізації;
Б) взаємодія кислотних оксидів з основними оксидами;
В) взаємодія кислоти з основним оксидом.
Наведіть конкретні приклади одержання кальцій фосфату кожним із запропонованих способів. Для чого в сільському господарстві використовуються фосфати? Подумайте, солі яких металів найбільш ефективні для використання з цією метою?
Завдання 5
Унаслідок розчинення різних речовин у воді розчин набуває лужного, нейтрального або кислого середовища. Поясніть це і підтвердьте рівняннями хімічних реакцій на нижченаведених прикладах.
А) Які з перелічених речовин – натрій оксид, кальцій, сульфур(ІV) оксид – взаємодіють із водою з утворенням лугу?
Б) Які з перелічених речовин – калій, барій оксид, сульфур(VІ) оксид – взаємодіють із водою з утворенням лугу?
В) Які з перелічених речовин – фосфор(У) оксид, силіцій оксид, сульфур(VІ) оксид – взаємодіють із водою з утворенням кислоти?
Учні виконують завдання самостійно по варіантах, з взаємоперевіркою.
IV. Підбиття підсумків уроку
Учитель оцінює роботу учнів і підбиває підсумки уроку.
V. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання до нього.
Творче завдання. Скласти схему одержання сульфатної кислоти із сірки. Обчислити масу одержаної сульфатної кислоти, якщо для реакції взяли сірку масою 128 г.
